

BIOLOGÍA Y GEOLOGÍA
BASE MOLECULAR DE LA VIDA
1.
BIOELEMENTOS, BIOMOLÉCULAS, AGUA Y
SALES MINERALES
CARACTERÍSTICAS DE LOS SERES VIVOS
Biología: ciencia que estudia la vida. ¿Qué es la vida? Dificultad de definición. Más sencillo es definir a los organismos vivos: los que realizan las funciones vitales, es decir, nutrición, relación, reproducción. Vida: es una propiedad de la materia. Propiedades emergentes: complejidad, organización, metabolismo, crecimiento, desarrollo, homeostasis, excitabilidad, reproducción, adaptación, evolución. Ser vivo: organismo capaz de automantenerse, reproducirse y evolucionar.LA BIOLOGÍA COMO CIENCIA
Biología: abarca zoología, botánica, anatomía, histología, citología, genética, microbiología, inmunología, ecología, etología,… Se ayuda de otras disciplinas: bioquímica, biofísica, biología molecular, genética molecular,… La biología es una ciencia empírica. Utiliza el método científico. Observación, elaboración de hipótesis, experimentación, análisis de resultados, conclusión, reelaboración de la hipótesis, nueva experimentación… Requiere un protocolo estricto de observación y experimentación. Sus resultados deben darse a conocer para que puedan ser contrastados. La ciencia sin divulgación no progresa. Hoy la biología ha traspasado los límites de la pura descriptiva y ha comenzado a ser cada vez más experimental, con gran impacto en la sociedad. La biología ha abierto la puerta a técnicas muy variadas y potentes: manipulación de genes, terapia génica, organismos transgénicos… Sin embargo, estas técnicas no están exentas de problemas éticos, jurídicos y económicos. La sociedad en su conjunto debe decidir los límites del uso de los descubrimientos científicos.UNIDAD QUÍMICA DE LOS SERES VIVOS
Los seres vivos son tremendamente diversos en apariencia, sin embargo, químicamente son muy similares y uniformes. De los más de 100 elementos de la tabla periódica, 70 participan en los seres vivos: son los elementos biogénicos. Casi todos los seres vivos están formados básicamente por 25 elementos y 6 de ellos constituyen el 95% de la materia orgánica. Materia viva=materia inerte. Usan los mismos elementos, pero en proporciones muy diferentes y con un nivel de complejidad muchísimo mayor en el caso de los seres vivos. Selección química: la materia en el universo es básicamente H y He; en la corteza terrestre abundan O, Si, Al, Mg, Fe, Mn,… en los seres vivos los elementos principales son H y O (en el agua), seguidos de C, N, S y P. Idoneidad de elementos para la vida: la “elección” de elementos para la vida se basó en criterios de disponibilidad, comportamiento en medio acuoso y reactividad. Elementos biogénicos o bioelementos: unos 70. Forman biomoléculas o principios inmediatos. Según su abundancia, se clasifican en: Mayoritarios: suman más del 98% de la materia orgánica. Son 11. A su vez, pueden ser: Primarios: 6 (C, H, O, N, S, P). Suman un 95%. Secundarios: 5. En menor proporción pero vitales en la fisiología celular. Mg, Ca, K, Na y Cl. Oligoelementos: menos del 0,1 %, pero vitales para el metabolismo. Oligoelementos esenciales: en todos los organismos. Son 14: Fe, Mn, Cu, Zn, Co, F, I, B, Si, V, Cr, Se, Mo, Sn. Oligoelementos no esenciales: en ciertos organismos. Unos 45. Li, Al, As, W, Ni… Biomoléculas: sustancias de los seres vivos formadas por combinación de bioelementos. Pueden ser: Inorgánicas: también se hallan en la materia inerte. Agua, sales minerales, gases (O 2 , CO 2 , N 2 …) Orgánicas: exclusivas de los seres vivos. Glúcidos, lípidos, proteínas y ácidos nucleicos. Idoneidad del carbono El C es un elemento atómico muy similar al Si (4 enlaces en tetraedro). Pero el C es mucho más flexible en cuanto a las uniones que puede realizar, ya que puede dar enlaces simples, dobles y triples. Puede formar moléculas lineales o ramificadas. Estas moléculas son estables en las condiciones terrestres, pero no tanto como para no poder reaccionar con otras. El C puede unirse a numerosos elementos (H, O, N, S, P…), dando una enorme diversidad de grupos funcionales. El CO 2 , fundamental en la fotosíntesis y la respiración, es un gas, lo que favorece su intercambio. El Si sólo forma cadenas lineales e inestables. Las moléculas más estables, los silicatos, forman las rocas, debido a su escasa reactividad. El SiO 2 , sílice, es sólido, el mineral más abundante de la naturaleza y casi inerte.EL AGUA
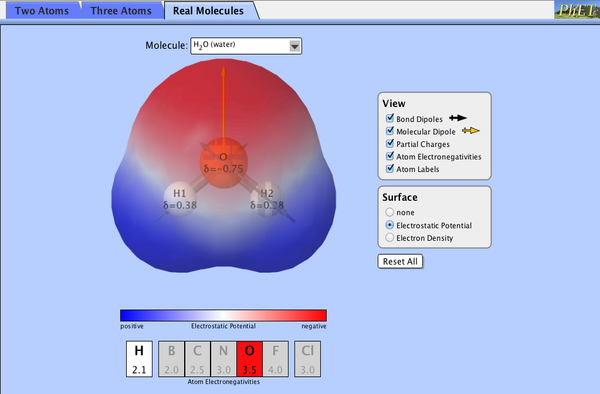
Es el llamado “líquido de la vida”: entre un 65% y un 95% de la mayoría de seres vivos es agua. Es casi seguro que en ella comenzó la vida. El agua tiene “propiedades extrañas”: muy reactiva, líquida entre 0 y 100 ºC, disolvente, menos densa en estado sólido,… Todas estas propiedades se deben a su estructura molecular. Agua: H 2 O. Está formada por dos átomos de hidrógeno y uno de oxígeno. Los orbitales del O forman un tetraedro. Debido a ello, el ángulo entre H y O es de 104,5º. Por otra parte, el O es muy electronegativo frente al H. Esto implica que el agua es una molécula neutra pero polar, con distribución asimétrica de los electrones. Los e - se concentran junto al O, dándole densidad de carga negativa (δ - ), y se alejan de los H, que muestran densidad de carga positiva (δ + ). La molécula de agua es un dipolo. Polaridad: permite la interacción de la molécula de agua con otras moléculas polares o cargadas eléctricamente. Y también entre las propias moléculas de agua, formando enlaces por puentes de H. Enlaces de H: son muy débiles e inestables, pero al ser muy abundantes, hacen que el agua tenga una estructura reticular muy estable, lo que le da sus propiedades. Propiedades y funciones biológicas del agua: Acción disolvente: gracias a los puentes de H. Según la solubilidad en agua se distinguen: sustancias hidrofílicas (se disuelven, son polares: azúcares, sal), hidrofóbicas (no se disuelven por ser no polares: hidrocarburos, muchos lípidos) y anfipáticas (se disuelven en medios acuosos y orgánicos, pues tienen regiones polares y apolares: ácidos grasos, fosfolípidos). El agua puede dar lugar a tres tipos de disoluciones: a. Moleculares: los solutos son moléculas orgánicas pequeñas, polares o con carga (alcoholes, azúcares, aminoácdos, proteínas,…) b. Iónicas: los solutos son electrolitos, sales disociadas en sus iones por solvatación del agua. c. Coloidales: los solutos son macromoléculas (grandes proteínas, ácidos nucleicos, polisacáridos…). No son verdaderas disoluciones, pero no precipitan por ser moléculas polares atraídas por las cargas del agua, con la que forman puentes de H. Las dispersiones coloidales son típicas de las células: citosol y nucleoplasma. Funciones biológicas debidas a la acción disolvente del agua: metabolismo (es el medio donde se dan la mayoría de las reacciones químicas, ya que los reactivos han de estar disueltos), transporte de nutrientes y desechos (detoxificación). Elevada fuerza de cohesión: la fuerza de cohesión es la que mantiene a las moléculas de agua unidas entre sí por los puentes de H. Esto hace que el agua sea incompresible (los puentes de H impiden que unas moléculas se acerquen a otras más allá de un límite). Funciones: esqueleto hidrostático (gusanos y otros invertebrados), turgencia (en células vegetales), tensión superficial (gotas de agua, flotación). Elevada fuerza de adhesión: la fuerza de adhesión es la que permite que las moléculas de agua puedan adherirse a otras moléculas, así como a determinadas superficies, mediante puentes de H con otras moléculas. Funciones: capilaridad (transporte de savia bruta en vegetales). Gran calor específico: el agua puede almacenar gran cantidad de energía sin aumentar temperatura, debido a que hay que romper puentes de H. Igualmente, al enfriarse libera mucha energía sin disminuir la temperatura. Funciones: tampón térmico, homeotermia. Elevado calor latente de evaporación: al evaporarse, el agua absorbe mucha energía (para romper puentes de H y pasar al aire). Función: refrigeración por transpiración (animales y plantas). Menor densidad del hielo: el agua presenta una máxima densidad a los 4 ºC. El hielo (0º) es menos denso y flota en el agua líquida. Función: supervivencia de organismos bajo aguas congeladas. Otras funciones: fotosíntesis (fuente de H); hidrólisis (rotura de enlaces: digestión, catabolismo). LAS SALES MINERALES Compuestos inorgánicos en los seres vivos. Pueden aparecer de forma precipitada (sales insolubles) o en solución (sales solubles). A. Sales insolubles: no se disuelven en agua, precipitan y forman estructuras sólidas, por lo que suelen tener función plástica (estructural) y actuar como protección y sostén: Caparazones de moluscos y crustáceos (carbonato cálcico (CaCO 3 )); caparazones silíceos de diatomeas y radiolarios (sílice). Esqueleto interno de vertebrados (huesos): fosfato, cloruro, fluoruro y carbonato de calcio. Fluoruro de calcio: esmalte dental, dureza 5 (apatito). Paredes vegetales de plantas: sílice en las hojas de gramíneas y ‘pelos’ urticantes de ortigas. Acumulaciones en células vegetales: oxalato cálcico. Son desechos vegetales, muy abundantes en espinacas, grelos, etc. Pueden provocar cálculos renales y biliares. Otolitos: cristales de carbonato cálcico en el oído de vertebrados para el equilibrio. Magnetita: en aves, tortugas, delfines, abejas…, para la orientación. B. Sales solubles: se disuelven en agua y aparecen disociadas en iones (cationes y aniones), llamados electrolitos. Realizan numerosas funciones: Funciones catalíticas: en conjunción con otras moléculas. Cu + , Mn 2+ , Mg 2+ , Zn + ,… son cofactores enzimáticos. El ión ferroso/férrico (Fe 2+ /Fe 3+ ) en el grupo hemo de la hemoglobina. El ión Mg 2+ en las clorofilas. El Ca 2+ para contracción muscular y coagulación sanguínea. Funciones osmóticas: paso del agua a través de membranas celulares: Na + , K + , Cl - , Ca 2+ . Participan en gradientes electroquímicos, potenciales de membrana y transmisión de impulsos nerviosos. Función tamponadora: mantienen el pH. Carbonato/bicarbonato (CO 3 2- /HCO 3- ) y monofosfato/bifosfato (H 2 PO 4 - /HPO 4 2- ). Nutrientes: los organismos autótrofos utilizan las sales (NO 3- , SO 4 2- , PO 4 3- , etc) para la síntesis de compuestos orgánicos.GASES
Algunos gases de la atmósfera o del agua son fundamentales para los seres vivos. Así, el O 2 en la respiración; CO 2 para la fotosíntesis y quimiosíntesis; N 2 en bacterias fijadoras de N; óxido nítrico (NO) como mensajero químico, vasodilatador, etc.FÍSICOQUÍMICA DE LAS DISPERSIONES ACUOSAS:
ÓSMOSIS Y PRESIÓN OSMÓTICA
La ósmosis es el paso de agua, a través de una membrana semipermeable (deja pasar el agua pero no el soluto), desde la disolución más diluida a la más concentrada. Presión osmótica sería la presión necesaria para impedir dicho flujo. Este proceso es importante en los seres vivos porque la membrana plasmática es semipermeable. Las células han de estar en equilibrio osmótico con su medio. Las disoluciones con igual concentración de solutos se denominan isotónicas. Una disolución es hipertónica si está más concentrada que otra (hipotónica). El comportamiento osmótico es diferente en células animales y vegetales: Células animales: en medio hipotónico entra agua. Las células se hinchan (turgencia) y pueden estallar (lisis, hemólisis en eritrocitos). En medio hipertónico sale agua: deshidratación y muerte (crenación en eritrocitos). Células vegetales: en medio hipotónico entra agua y se produce la turgencia, pero la pared vegetal impide la lisis. En medio hipertónico sale agua, la membrana se separa de la pared y se rompe (plasmólisis), dando deshidratación y marchitez.DIFUSIÓN Y DIÁLISIS
Además de la ósmosis, las disoluciones pueden dar lugar a otros procesos: Difusión: tiene lugar cuando dos disoluciones de diferente concentración están separadas por una membrana permeable (deja pasar tanto el agua como los solutos) o sin membrana. En este caso se produce el paso de solutos desde la disolución hipertónica a la hipotónica. Diálisis: esta técnica permite separar solutos de pequeño tamaño de una disolución. Para ello se emplean membranas con poros de tamaño determinado. Se usa, por ejemplo, en personas con problemas renales, para filtrar la sangre de sustancias tóxicas. Datos curiosos DL50 (Dosis Letal Mediana) de algunas sustancias (los totales están calculadas para una persona de unos 80 kg): Agua: 90 ml/kg (unos 8 litros diarios pueden matar). Sal: 250 g de un golpe. Azúcar (sacarosa): 29,7 g/kg (unos 2,5 kilos de azúcar). Alcohol: 400-450 ml (unas 3 botellas de vodka en una hora). Plomo: 450 mg/kg (unos 37,35 g. ¡Siempre que no sea una bala!) Nicotina: 150 cigarrillos de golpe. Cafeína: 100 mg (unas 150 tazas de café o 4,5 litros). Arsénico: 13 mg/kg (unos 100 mg). Toxina botulínica: 1,3 a 2,1 ng/kg (unos 170 ng).




























































































































Obra de la pintora impresionista Samantha French










Craig Venter


BIOLOGÍA 2º BACHILLERATO







Para ir a donde no se sabe hay que ir por donde no se sabe.” San Juan de la Cruz
“It must be a strange world not being a scientist, going through life not knowing--or
maybe not caring about where the air came from, where the stars at night came from or
how far they are from us. I WANT TO KNOW” Michio Kaku
“Nullius in verba” Robert Boyle, Christopher Wren y Robert Hooke

Fragmento de la serie Breaking Bad sobre
composición del ser humano




BASE MOLECULAR DE LA VIDA


















Modelo de protón con sus 3 quarks


ING. Somos química
































![Cerrar [x]](bg2bto_htm_files/close.png)



















